昨天,我們跟大家聊了有關臨床評價的內容,今天我們聊得更細一點——臨床評價等同性論證。
對於需要進行臨床評價的第二類、第三類醫療器械,很多時候會選擇通過等同器械的臨床數據進行臨床評價,那麼此時就需要進行等同性論證。
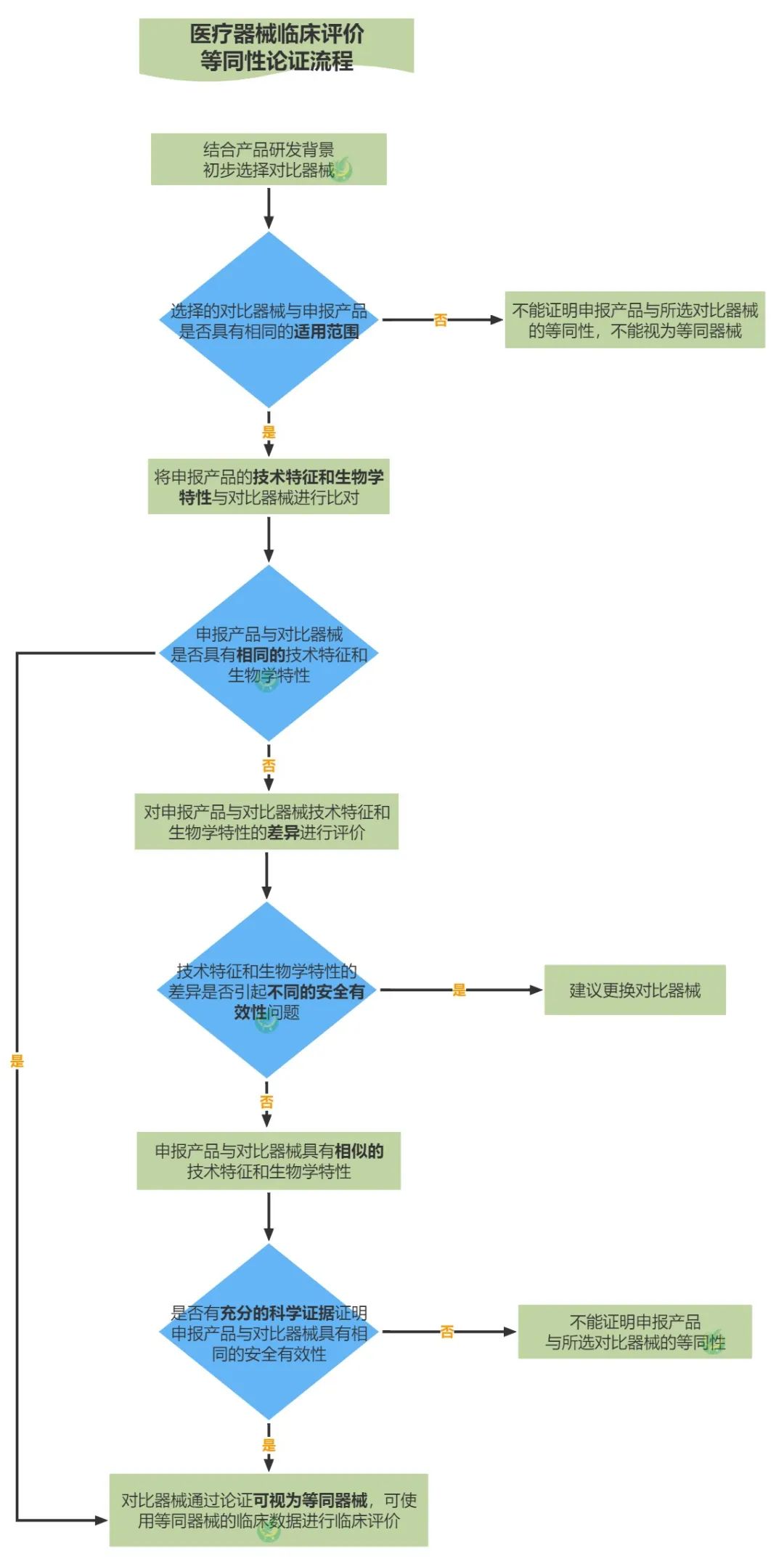
等同性論證是指將適用範圍相同的申報產品與對比器械在技術特征和生物學特性方麵進行比對,證明二者基本等同的過程。基本等同包括兩種情形:
(一)申報產品與對比器械具有相同的適用範圍、技術特征和生物學特性;
(二)申報產品與對比器械具有相同的適用範圍,相似的技術特征和生物學特性;有充分的科學證據證明申報產品與對比器械具有相同的安全有效性。
接下來我們再來看看等同性論證的基本要求。
申報產品與對比器械
是否具有相同的適用範圍
也就是說,通過對申報產品與對比器械的適用範圍及臨床使用相關信息的比較,對二者差異進行充分識別、詳細闡述及科學評價,以做出適用範圍是否相同的判定。
二者是否具有相同/相似的
技術特征、生物學特性
相關支持性資料的準備
等同性論證時,申報產品與對比器械進行比對時所用的數據和信息,二者存在差異時證明其具有相同的安全有效性所用的有效科學證據,均為等同性論證的支持性資料。
支持性資料通常需包括準確、可靠、完整、可追溯的數據,必要時包括數據的產生過程,試驗/實驗數據建議來自有良好質量控製的實驗室;僅在極少數情形下,可使用一般性描述(如行業的普遍性共識)。未經證實的觀點,以及未基於詳細數據的科學評價報告不能作為支持性資料。
最後附上等同性論證流程圖,大家可以收藏備用哦☟
醫療器械注冊谘詢認準金飛鷹
深圳:0755-86194173
廣州:020 - 82177679
湖南:0731-22881823
四川:028 - 68214295


