臨床評價,指的是采用科學合理的方法對臨床數據進行分析評價,以確認醫療器械在其適用範圍下的安全性、臨床性能和/或有效性的持續進行的活動。臨床評價需持續開展,貫穿醫療器械全生命周期。
在醫療器械注冊過程中,除了免於臨床評價目錄裏的產品,其他產品都是需要提交臨床評價資料的,那麼臨床評價的範圍和流程具體是怎樣的呢?今天我們就來聊一聊。
根據需從臨床角度確認的安全和性能基本原則,確定臨床評價範圍,考慮因素包括:
需要特別關注的設計特征或者目標使用人群。臨床評價需涵蓋可導致特別性能或安全關注的所有設計特征(例如含藥器械、人源或動物源組分)、器械的適用範圍及臨床使用相關信息(例如目標人群和疾病、警告、禁忌證以及使用方法)以及注冊申請人宣稱的產品安全性、臨床性能和/或有效性。
將同品種醫療器械的臨床數據用於支持申報產品的安全性、臨床性能和/或有效性。注冊申請人可通過同品種醫療器械的臨床數據進行申報產品的全部或部分臨床評價,但必須考慮差異性對產品安全性、臨床性能和/或有效性產生的影響。
用於臨床評價的數據來源和數據類型。注冊申請人選擇數據類型時,考慮因素包括產品設計、適用範圍以及風險、產品技術的發展背景(新技術還是成熟技術)、成熟技術的臨床使用。如果產品基於現有成熟技術且不改變適用範圍時,最有可能通過同品種醫療器械的臨床數據完成臨床評價。基於無經驗或經驗極少的新技術或者現有技術擴展適用範圍的高風險產品,更有可能要求提供臨床試驗數據。
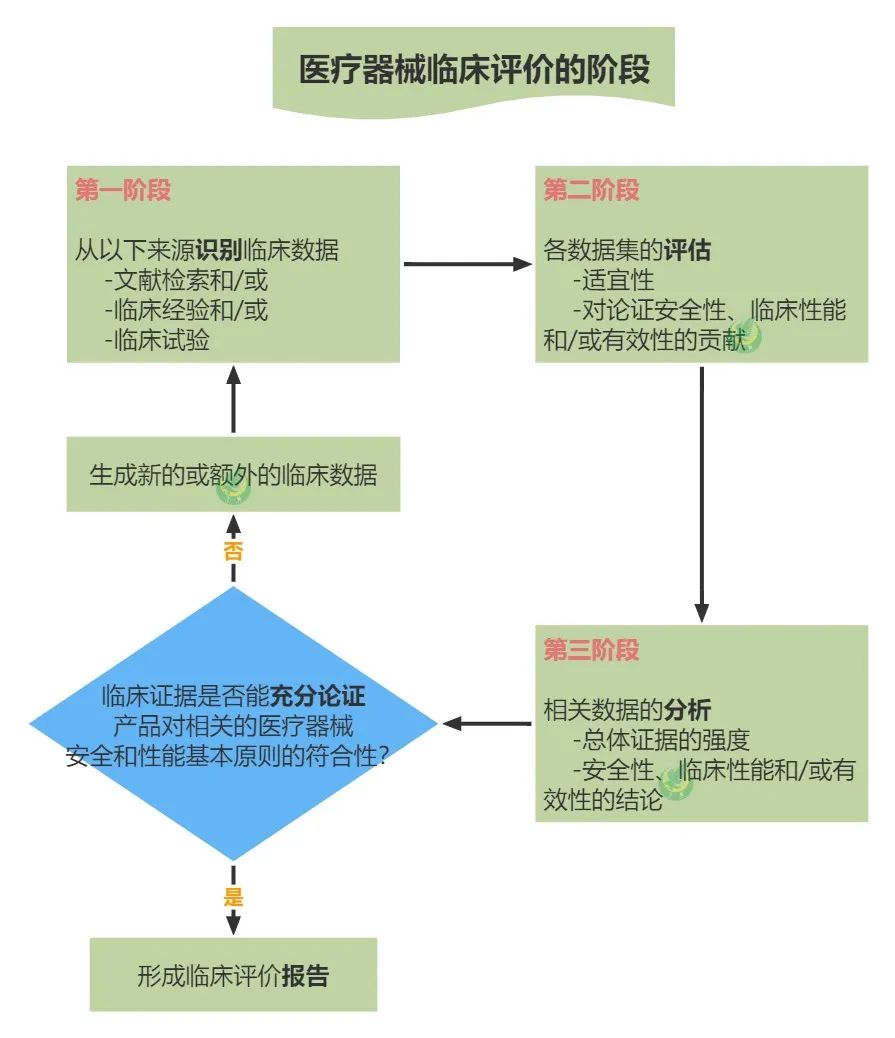
確定評價範圍後,臨床評價包括三個階段:
1.識別相關臨床數據;
2.評估各數據集的適宜性和貢獻;
3.分析各數據集,得出產品安全性、臨床性能和/或有效性以及產品臨床使用相關信息方麵(如說明書和標簽等)相關的結論。
具體見下圖:
醫療器械注冊谘詢認準金飛鷹
深圳:0755-86194173
廣州:020 - 82177679
湖南:0731-22881823
四川:028 - 68214295


