連日來,全國各地紛紛出台新政策,對新冠肺炎疫情防控措施進行調整,在諸多場所取消對查驗核酸陰性證明的要求,由此,抗原檢測試劑需求呈現上升趨勢,多地開始試行抗原自測,如廣州衛健委提出“鼓勵家庭自備抗原試劑盒”。在此情形下,部分地區表示“一盒難求”。

這裏提到的抗原試劑盒,全名叫“新型冠狀病毒(2019-nCoV)抗原檢測試劑盒”。我們在國家藥監局官網搜索顯示,截至目前,國家藥監局已批準的新冠病毒抗原檢測試劑產品共有33款。

目前列表裏的產品都是通過應急審批的方式投入市場的,據國家藥監局2021年12月發布的《醫療器械應急審批程序》第十四條:“對於應急審批醫療器械,附條件批準上市的,醫療器械注冊證的有效期與注冊證注明的附帶條件的完成時限一致,原則上不超過1年。如注冊人完成附帶條件,可以在到期之日前申請辦理延續注冊,符合要求的給予延續注冊,注冊證有效期為5年。”
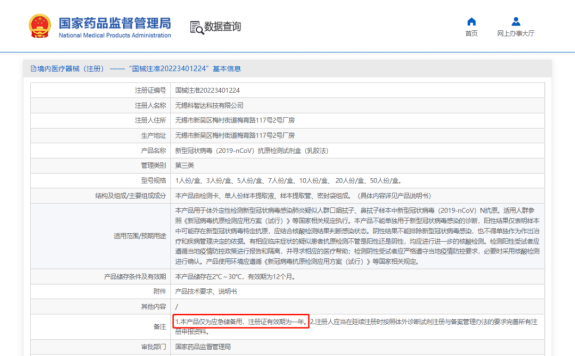
▵點開注冊證詳情,備注欄裏有“注冊證有效期為一年”的說明
接下來,通過新冠抗原試劑盒進行居家健康監測也許會成為常態,今天,我們就來聊一聊新型冠狀病毒(2019-nCoV)抗原檢測試劑注冊審查的相關要點。
產品名稱應符合《體外診斷試劑注冊與備案管理辦法》(國家市場監督管理總局令第48號)及相關法規的要求,如新型冠狀病毒(2019-nCoV)抗原檢測試劑盒(膠體金法)。根據《體外診斷試劑分類規則》,該產品按照第三類體外診斷試劑管理,分類編碼為6840。
包括產品列表、關聯文件、申報前與監管機構的聯係情況和溝通記錄以及符合性聲明等文件。
綜述資料主要包括概述、產品描述、預期用途、申報產品上市曆史及其他需說明的內容。其中,產品描述中應詳述檢測原理、產品主要研究結果的總結和評價、與同類和/或前代產品的比較等。與同類和/或前代產品的比較,應著重從方法學、檢驗原理、產品主要性能等方麵詳細說明申報產品與目前市場上已獲批同類產品之間的主要區別。
依據國家標準、行業標準及有關文獻資料,結合產品特性按照《醫療器械產品技術要求編寫指導原則》(2022年第8號)的要求編寫。該類產品作為第三類體外診斷試劑,應當以附錄形式明確主要原材料以及生產工藝要求。
新型冠狀病毒抗原檢測試劑已有國家標準品,技術要求中應體現國家標準品的相關要求,並使用國家標準品對三批產品進行檢驗。
注冊申請人應采用在符合質量管理體係的環境下生產的試劑盒進行所有分析性能研究,可著重對樣本穩定性、適用的樣本類型、精密度、包容性、檢出限、分析特異性、高劑量鉤狀效應、反應體係等分析性能進行研究,提交具體研究方法、試驗方案、試驗數據、統計分析等詳細資料。
穩定性研究主要包括實時穩定性(有效期)、開瓶(開封)穩定性、高溫加速破壞穩定性、運輸穩定性等,注冊申請人可根據實際需要選擇合理的穩定性研究方案。穩定性研究資料應包括研究方法的確定依據、具體的實施方案、詳細的研究數據以及結論。對於實時穩定性研究,應提供至少三批樣品在實際儲存條件下保存至成品有效期後的研究資料。
提交對申報試劑陰性/灰區/陽性等結果判斷的陽性判斷值(cut-off,CO)確定的研究資料,包括具體的試驗方案、人群及受試者樣本選擇、評價標準、統計學分析和研究數據等。建立陽性判斷值使用的樣本來源的選擇應考慮到不同的地理區域、不同的感染階段和生理狀態等因素的影響。如果產品適用不同樣本類型,需要對所有樣本類型進行陽性判斷值的驗證。
包括主要原材料研究資料、生產工藝的研究資料等。
該類試劑應通過臨床試驗路徑進行臨床評價。臨床試驗應符合《體外診斷試劑注冊與備案管理辦法》(國家市場監督管理總局令第48號)、《體外診斷試劑臨床試驗技術指導原則》(國家藥品監督管理局通告2021年第72號)的要求,如相關法規、文件有更新,臨床試驗應符合更新後的要求。
臨床試驗中應重點關注產品臨床性能評價、可用性評價、結果判讀能力評價、境外臨床試驗數據的認可、臨床評價資料的形式要求。
產品說明書格式應滿足《體外診斷試劑說明書編寫指導原則》的要求。產品說明書的所有內容均應與注冊申請人提交的注冊申報資料的相關研究結果保持一致。如某些內容引用自參考文獻,則應以規範格式對此內容進行標注,並單獨列明參考文獻的相關信息。
醫療器械注冊谘詢認準金飛鷹
深圳:0755-86194173
廣州:020 - 82177679
湖南:0731-22881823
四川:028 - 68214295


