9月11日,“上海器審”公眾號發布公告稱,2022年度上海市器審中心對有源類醫療器械生產企業(設備類,不含獨立軟件產品)開展了現場體係核查,涉及核查產品為185個。通過分析現場核查不符合項發現,127家次現場體係核查合計發現缺陷835項,其中關鍵不符合項254項,一般不符合項581項。
從各章節不符合項總數占比來看,占據前四位的分別為設計開發(27%)、生產管理(18.5%)、質量管理(17.3%)和采購(15.7%)。
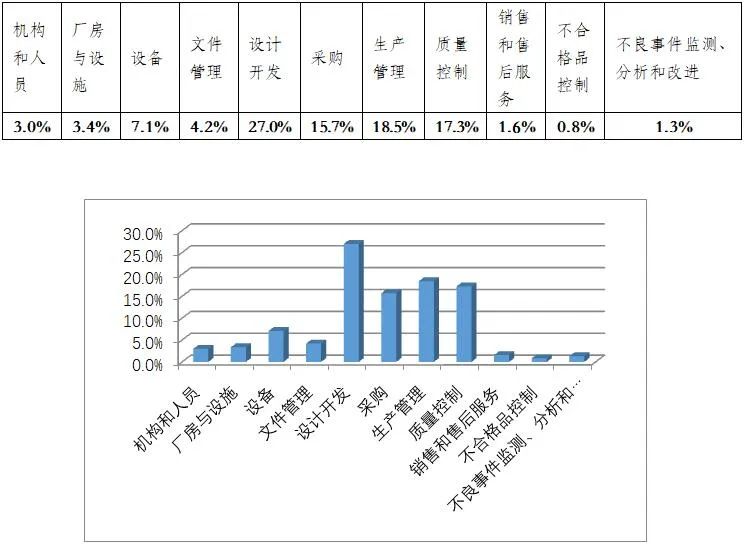
▵不符合項分布情況
我們對本次“上海器審”總結出來的現場核查常見問題進行轉載,以供相關企業參考:
現場檢查發現設計過程控製存在不足,主要體現在以下幾方麵:
注冊人委托生產企業進行生產時,委托協議中雙方對研發的職責不明確,注冊人和受托生產企業對設計文件的轉移不充分。
2)設計開發研發過程和輸出資料缺失。如現場未查見主控板的元器件、BOM清單、技術圖紙、主板電路原理圖、軟件源代碼等技術研發資料,或與實際生產樣機、產品說明書存在不一致。
3)設計驗證不充分。如缺少對產品主要性能參數或與外部配合使用器械的驗證及相關記錄,產品部分功能未在技術要求中提及,未完成相關驗證。
4)設計變更未進行及時的識別、評審、驗證和確認。
5)產品風險分析及控製措施評價不充分,如產品開發新功能時未充分考慮臨床使用過程中的風險,未考慮產品故障情況下的非預期使用可能產生的風險。
現場檢查主要發現采購質量協議中未明確采購要求、主要部件未能滿足采購追溯等問題,主要體現在以下幾方麵:
1)采購質量協議或采購合同中對主要采購部件的材質、性能、技術參數、質量標準等方麵未做明確要求。
2)原材料的進貨檢驗規範或驗證內容浮於表麵,僅對外觀、尺寸提出要求,未覆蓋關鍵性能參數,與技術要求中整機性能參數有衝突。
3)涉及軟件委外研發時,開發協議中未明確軟件需求、交付技術文件內容、驗收標準、軟件更新及維護等內容。
4)關鍵部件未能追溯到供方的批號,對原材料批量問題無法開展分析和追溯。
現場檢查發現生產工藝不充分或關鍵控製點不明確、生產記錄不完整、主要零/部件無法追溯等問題,主要體現在以下幾方麵:
1)部分企業存在生產過程簡單的問題,未對產品生產工序進行合理、有效分解細化,過度依賴部件模塊化。
2)未對調試等關鍵工序製定詳細的作業指導書,存在依據經驗進行生產的情況。
3)生產過程未按照作業指導書中的要求執行,生產記錄簡單,未記錄關鍵部件序列號或編號、軟件完整版本號,無法滿足可追溯的要求。
現場檢查發現檢驗規程不充分、檢驗記錄不完整、檢驗過程無法追溯等問題,主要體現在以下幾方麵:
1)對檢驗規程未能覆蓋產品技術要求的檢驗項目,也未采取抽檢或過程控製等有效的質量管控方式。
2)檢驗方法與產品技術要求或國家標準有區別時,企業未對所采用的方法進行科學有效的確認,未能提供上述不同方法的等同性說明。
3)檢驗記錄缺少原始數值記錄,檢驗結果無法重現或追溯。
4)對於檢驗條件和設備要求較高,企業不具備檢驗能力的,也未委托具有資質的機構進行檢驗,以證明產品符合強製性標準和經注冊的產品技術要求。
5)產品分別存在使用模式和檢驗模式的情況下,未對檢驗用軟件進行充分確認。
信息來源:上海器審
排版整理:金飛鷹藥械
醫療器械注冊谘詢認準金飛鷹
深圳:0755-86194173
廣州:020 - 82177679
湖南:0731-22881823
四川:028 - 68214295


