根據《醫療器械注冊與備案管理辦法》第三十八條:
第三類醫療器械進行臨床試驗對人體具有較高風險的,應當經國家藥品監督管理局批準。
臨床試驗審批是指國家藥品監督管理局根據申請人的申請,對擬開展臨床試驗的醫療器械的風險程度、臨床試驗方案、臨床受益與風險對比分析報告等進行綜合分析,以決定是否同意開展臨床試驗的過程。
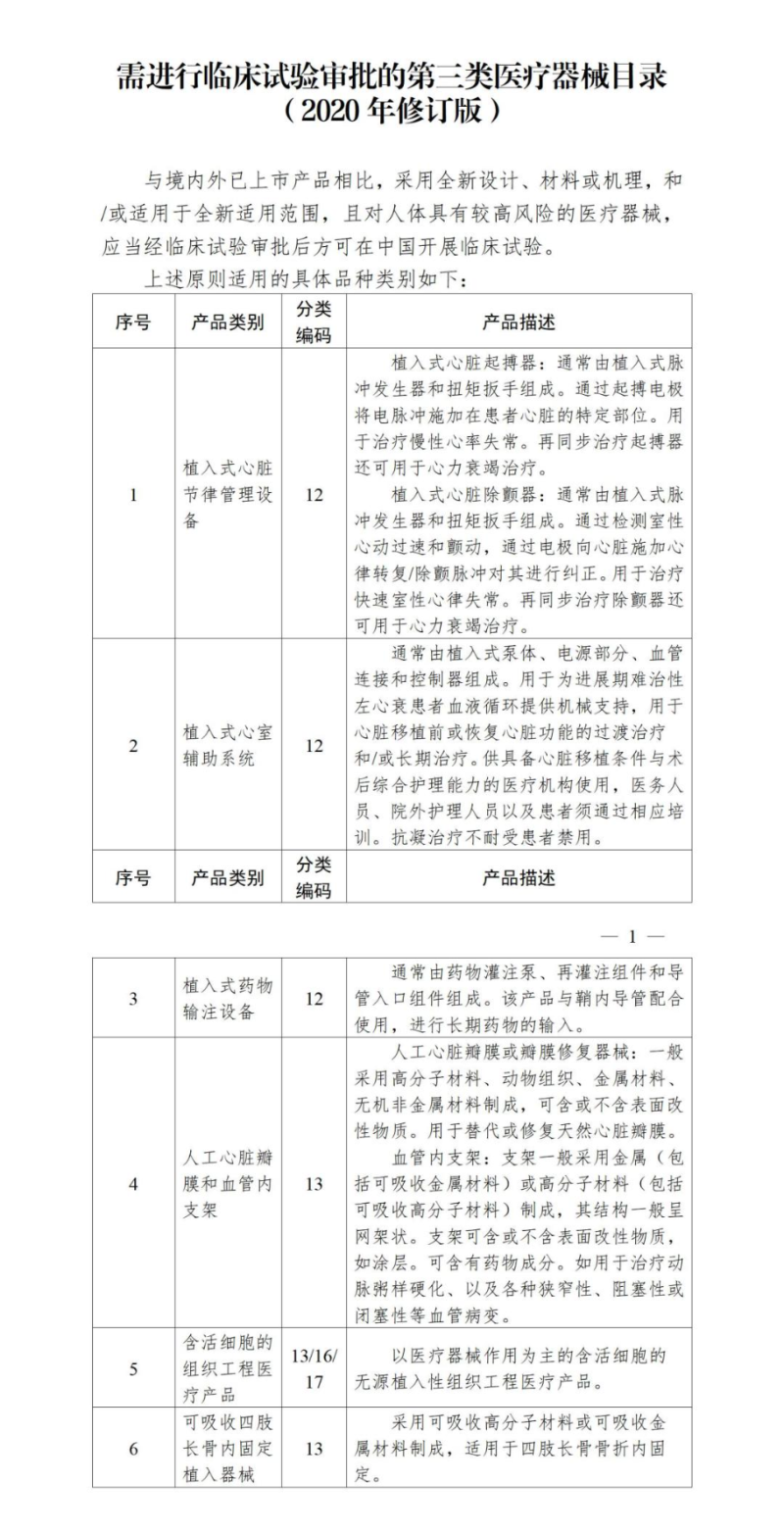
需進行臨床試驗審批的第三類醫療器械目錄由國家藥品監督管理局製定、調整並公布。需進行臨床試驗審批的第三類醫療器械臨床試驗應在符合要求的三級甲等醫療機構開展。
那麼目前有哪些醫療器械產品需進行臨床試驗審批呢?根據《國家藥監局關於發布需進行臨床試驗審批的第三類醫療器械目錄(2020年修訂版)的通告(2020年第61號)》,需進行臨床試驗審批的第三類醫療器械產品具體如下:
醫療器械注冊谘詢認準金飛鷹
深圳:0755-86194173
廣州:020 - 82177679
湖南:0731-22881823
四川:028 - 68214295


