
12月11日,國家藥監局器審中心發布《麵部注射填充材料臨床試驗注冊審查指導原則(征求意見稿)》《體外膜肺氧合係統臨床評價注冊審查指導原則(征求意見稿)》等4項醫療器械注冊審查指導原則,並向社會公開征求意見。
意見反饋時間:2024年1月2日前
我們將《麵部注射填充材料臨床試驗注冊審查指導原則》部分重點內容摘錄如下:
本指導原則適用於整形用麵部注射填充物,預期注射到真皮層和/或皮下組織、骨膜上層以填充增加組織容積,具體包括以下產品:
用於糾正鼻唇溝皺紋(真皮中層及深層、皮下組織淺層)、改善外鼻體積及形態(骨膜上層)、矯正中麵部容量缺失和/或中麵部輪廓缺陷(皮下組織和/或骨膜上層)、矯正唇部不對稱或輪廓畸形及唇部容積缺損等結構缺陷(唇紅體和唇紅緣的唇粘膜下層、真皮淺層或中層)、改善輕度至中度下頜後縮患者下頜輪廓(骨膜上層)的注射用透明質酸鈉凝膠(包括經化學交聯,不包括複合溶液);
用於糾正鼻唇溝皺紋(真皮組織)、糾正額部動力性皺紋(真皮組織)的動物源膠原蛋白產品、用於糾正額部動力性皺紋(真皮組織)的重組Ⅲ型人源化膠原蛋白產品;
用於改善外鼻體積及形態(骨膜上層)的整形用膠原和聚甲基丙烯酸甲酯皮下植入物係統;
用於糾正鼻唇溝皺紋(真皮深層)的聚左旋乳酸麵部填充劑、用於糾正鼻唇溝皺紋(皮下組織)的聚己內酯麵部填充劑。
按現行《醫療器械分類目錄》,該類產品分類編碼為13-09-02,管理類別為Ⅲ類。
若申請人提交境外臨床試驗數據,需符合《接受醫療器械境外臨床試驗數據技術指導原則》的要求,例如考慮到與中國人群皮膚特征的相似度,境外臨床試驗需基於東亞人群開展,且符合本指導原則要求。
以申請首次注冊上市為目的的該類產品臨床試驗需是前瞻性、隨機對照臨床試驗。根據設計預期的臨床意義及試驗醫療器械的性能選擇合適的試驗類型(優效/等效/非劣效)。對於同一產品具有多個適應證時,建議針對不同適應證分別進行臨床試驗設計。
建議采用適用範圍相同的已上市同類產品作為對照醫療器械,優先選擇與試驗醫療器械組成成分、產品性能相似的產品作為對照醫療器械。如選擇空白對照,需重點考慮臨床試驗的倫理性;試驗應為優效設計,且臨床評價資料可證明,申報產品的絕對效應和安全性指標評價不差於已上市同類產品。
需盡可能地采用盲法以避免主觀影響因素,如對受試者設盲及對第三方評價者設盲。如果可行,建議還應對注射操作者設盲。
本部分僅對本指導原則提及的適應證進行舉例討論。
1.主要有效性評價指標
如對於注射用重組Ⅲ型人源化膠原蛋白溶液,若適用範圍為該產品用於麵部真皮組織填充以糾正額部動力性皺紋(包括眉間紋、額頭紋和魚尾紋)或對於聚乳酸麵部填充劑產品,若適用範圍為用於注射到真皮深層,以糾正中重度鼻唇溝皺紋。建議將所宣稱的效果持續時間點上的對皺紋糾正的有效率設為主要有效性評價指標。皺紋糾正有效率定義為,皺紋嚴重程度的分級(如Wrinkle Severity Rating Scale, WSRS)較術前至少減輕一個等級的受試者例數百分比。對於同一受試者的雙側數據,需明確取舍規則。表1提供了一個評價皺紋嚴重程度的量表示例。
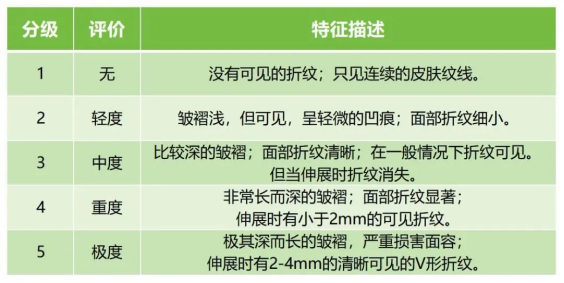
↑表1 評價皺紋嚴重程度參考量表(示例)
如對於注射用交聯透明質酸鈉凝膠,若適用範圍為用於鼻背、鼻小柱和前鼻棘部位骨膜上層(硬骨膜上和/或軟骨膜上)注射,以改善外鼻體積及形態。建議將所宣稱的效果持續時間點上測量的鼻背和/或鼻根體積相對於基線的平均變化值設為主要有效性評價指標。
如對於注射用交聯透明質酸鈉凝膠,若適用範圍為用於矯正中麵部容量缺失和/或中麵部輪廓缺陷,注射層次為皮下組織、骨膜上層。建議將觀察末次注射後所宣稱的效果持續時間點時的治療有效率作為主要評價指標。如可采用麵中部容量量表評分 (Medicis Mid-Face Volume Scale,MMVS,見表2)或麵中部容積缺陷量表評分(Mid-Face Volume Deficit Scale,MFVDS,見表3),且與基線相比,評分顯示改善≥1級的受試者被視為治療有效。
表2和表3分別提供麵中部美容效果評價的兩種示例。

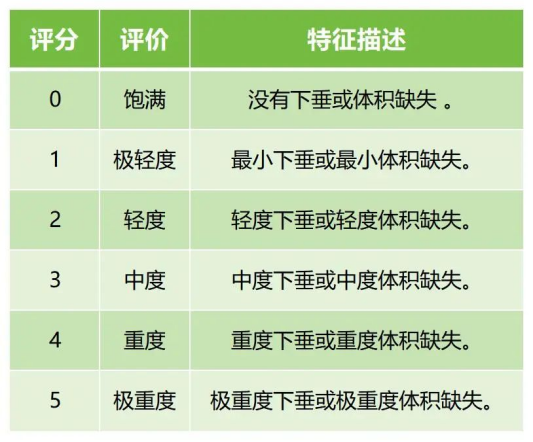
↑表3 麵中部容積缺陷量評分量表(MFVDS)(示例)
如對於注射用交聯透明質酸鈉凝膠,若適用範圍為通過注射至唇紅體和唇紅緣的唇粘膜下層、真皮淺層或中層,以矯正唇部不對稱、輪廓畸形和容積缺損等結構缺陷。建議將觀察末次注射後所宣稱的效果持續時間點訪視時的豐唇治療效果作為主要評價指標。如可采用嘴唇豐滿度量表評分(Lip Fullness Scale2, LFS2,見表4),與基線相比,LFS2評分顯示改善(豐滿度增加)≥1級的受試者被視為豐唇有效。

↑表4 唇部豐滿度參考量表(LFS2)(示例)
如對於注射用交聯透明質酸鈉凝膠,若適用範圍為用於注射到骨膜上層,填充下頜區域,以改善輕度至中度下頜後縮患者的下頜輪廓。建議將觀察末次注射後的治療有效率作為主要評價指標。如可采用Galderma下頜後縮評估量表評分(GCRS,見表5)。與基線相比,GCRS評分顯示改善≥1級的受試者被視為治療有效。

↑表5 Galderma下頜後縮評估量表(GCRS)(示例)
有效性評價一般由獨立於注射操作者的專業人員進行評估。若采用其他指標作為主要有效性評價指標需提供充分依據,如主要評價指標采用其他評價皺紋嚴重程度參考量表,量表應經過驗證並建議向臨床機構提供各分級相對應的皺紋圖片以方便研究者進行參考判斷分級。
試驗方案中需明確主要評價指標采集數據的方法(如現場評判還是根據照片評判),需采取措施盡量減小其他因素(如環境光線、觀察或拍照角度等)對評判結果造成的影響。如采集數據采用臨床公認的設備測量,需明確設備名稱、型號、生產廠家等基本信息,並提供其測量結果準確性的研究驗證資料,如設備按照醫療器械管理需取得醫療器械注冊證。
2.次要有效性評價指標
次要有效性評價指標建議包括研究者的整體美觀改善效果評價(Global Aesthetic Improvement Scale, GAIS),受試者的整體美觀改善效果評價(GAIS)。
表6提供了全局美容效果評價分級的一個示例。
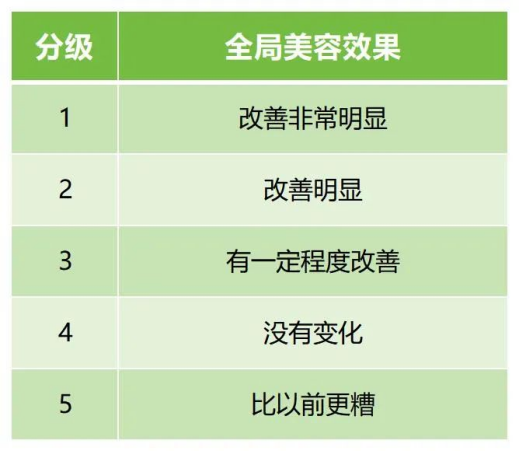
↑ 表6 麵部整體麵容效果改善效果分級量表(GAIS)(示例)
如對於注射用重組Ⅲ型人源化膠原蛋白溶液,若適用範圍為該產品用於麵部真皮組織填充以糾正額部動力性皺紋(包括眉間紋、額頭紋和魚尾紋)或對於聚乳酸麵部填充劑產品,若適用範圍為用於注射到真皮深層,以糾正中重度鼻唇溝皺紋;次要評價指標一般還應包括研究者對除主要有效性評價觀察時間點外其他時間點的皺紋嚴重程度的評價(WSRS)。
如對於注射用交聯透明質酸鈉凝膠,若適用範圍為用於矯正中麵部容量缺失和/或中麵部輪廓缺陷,注射層次為皮下組織、骨膜上層;次要評價指標一般還應包括研究者對輪廓填充效果評價。
如對於注射用交聯透明質酸鈉凝膠,若適用範圍為用於鼻背、鼻小柱和前鼻棘部位骨膜上層(硬骨膜上和/或軟骨膜上)注射,以改善外鼻體積及形態;次要評價指標對采用測量設備評價外鼻正中矢狀麵增高情況也進行評價。
臨床試驗的次要評價指標注射後觀察時間需根據產品維持有效性的時間和產品預期降解所需的時間確定。觀察時間點的設定應至少包括注射前、注射後即刻、觀察隨療效變化情況的各時間點。
如,用於鼻唇溝未經交聯的透明質酸鈉產品臨床試驗注射後的持續觀察時間建議不短於6個月。用於鼻唇溝經交聯的透明質酸鈉凝膠產品臨床試驗注射後的持續觀察時間建議不短於1年。對於其他材料的麵部注射填充材料,若經動物試驗驗證,如降解時間較短,建議有效性評價時間至少觀察至產品完全降解;如降解時間較長,建議結合產品的降解時間適當延長產品的有效性評價時間,一般應觀察至降解穩態(如1年),並在後續的臨床使用過程中係統觀察產品的中遠期的效果。
對於含利多卡因的透明質酸鈉凝膠,考慮到產品含利多卡因的濃度、給藥方式和劑量與現有臨床應用情形不同。建議在次要評價指標中關注14天內的疼痛改善情況(如,可采用VAS評分標準),並與對照組進行對比。
3.安全性評價指標
安全性評價指標應包括,基本生命體征、注射前和注射後各有效性評價時間點的實驗室檢查(如血、尿常規檢查、肝功能檢查、腎功能檢查)等,對中遠期注射部位周圍組織的影響、填充材料移位堆積情況。對於降解時間較長或不可降解等材料,還需關注填充材料遊離風險(包括位移風險和材料碎片遊離導致的栓塞風險)。
注射填充過程存在非主觀性注射到血管內的風險,雖然發生率很低,但其造成的不良事件可能是嚴重且永久性的,包括視覺異常和失明。因此,建議申請人主動監測受試者是否發生視覺障礙(包括但不限於視力喪失、視力模糊、雙重視覺、眼部或周圍區域疼痛、視野中的盲點或陰影、眼球運動困難等)。對於已出現視覺障礙的受試者需進一步觀察對神經係統的影響(如中樞神經係統並發症)。
除此之外,安全性評價指標還需要包括對不良事件的觀察,可能包括:
1)注射反應:如進針處滲血、輕度腫脹、瘀斑和疼痛等;
2)過敏反應(包括速發性和遲發性):早期表現為紅斑、丘疹、蕁麻症、血管性水腫、過敏性休克等;遠期表現為遲發性紅斑和炎性肉芽腫;
3)感染:包括內源性病原體被激活或外界病原體侵入,以及生物膜形成以及血管栓塞導致皮膚供血障礙繼發的感染等;表現為局部紅、腫、熱、痛,皮溫升高,腫脹,甚至膿腫形成,少數患者可出現全身性反應;
4)丁達爾現象:在皮膚較薄部位注射較多的透明質酸或注射層次偏淺,引起局部皮膚在光線照時下呈現藍色;
5)結節和條索狀隆起(注射總量過多或者注射層次過淺所致);
6)肉芽腫反應:表現為注射部位出現皮膚紅斑、腫脹、變色和皮下結節;
7)血管栓塞:常見栓塞部位為麵部淺層血管,也可發生眼動脈及其分支,甚至顱內動脈的栓塞,可導致組織壞死、失明甚至危及生命;
8)其他:如注射過淺過快阻礙真皮血管網血流可導致皮膚發白,注射過深造成填充不足,注射後毛細血管擴張、局部刺激引起的紅、腫及感覺異常等遲發性炎症反應。
臨床試驗安全性評價指標的觀察時間應結合產品材料學特性和產品預期降解時間進行設計。觀察時間點應至少包括短期安全性評價時間點(如注射後1周或2周)、治療過程中安全性評價時間點及中遠期安全性評價時間點。
建議收集受試者在注射後14天內的局部反應日誌。若存在補充注射的情況(按照產品說明書中的使用方法),應從補充注射之日起開始計算觀察時間點。建議對於降解時間較長或不降解的產品,安全性評價終點應設計為產品達到降解穩態(如1年),並在後續的臨床使用過程中繼續係統觀察產品的遠期安全性。
信息來源:國家藥監局器審中心
排版整理:金飛鷹藥械
醫療器械注冊谘詢認準金飛鷹
深圳:0755-86194173
廣州:020 - 82177679
湖南:0731-22881823
四川:028 - 68214295


