
歐洲當地時間12月14日,歐盟發布MDCG 2023-5"Guidance on qualification and classification of Annex XVI Products",對MDR附錄十六中非預期醫療用途產品的界定及分類規則進行了進一步明確,這是一份專門針對製造商及公告機構的指南文件,以便為他們在具體產品上市申報時提供更多參考。
關於此類產品的界定,指南文件中提到了以下幾種情形:
如果附件產品隻能與MDR附錄十六中的產品聯合使用,則它可以與該產品一起投放市場,並被視為該產品的一部分。
如果附件產品可以單獨使用或與其他MDR附錄十六中的產品聯合使用,則可以單獨作為附錄十六的產品,或與聯合使用的產品一起投放市場。在後一種情況下,它可被視是這些產品的一部分。
如果製造商聲稱產品有醫療和非醫療兩種預期用途,這些被稱為雙用途設備的產品必須同時滿足適用於有預期醫療目的設備和沒有預期醫療目的設備的要求。
原則上,每一種產品應該隻屬於MDR附錄十六所列的6組之一。然而,如果一個產品達到了兩組或兩組以上產品的預期目的,並且具有這些組中描述的所有特征,則應同時滿足CS中為這些組設定的要求。
不被列入非預期醫療用途產品目錄,不適用於CS的產品,具體有對隱形眼鏡進行消毒/清洗和衝洗的產品(應為醫療器械)、在頭發移植手術中轉移毛囊的設備等。
除此之外,此次指南文件同時對非預期醫療用途產品分類規則的應用進行了解釋和實例說明,並詳細介紹了MDR附錄十六中所列的無預期醫療用途的6組產品應考慮的分類要素。
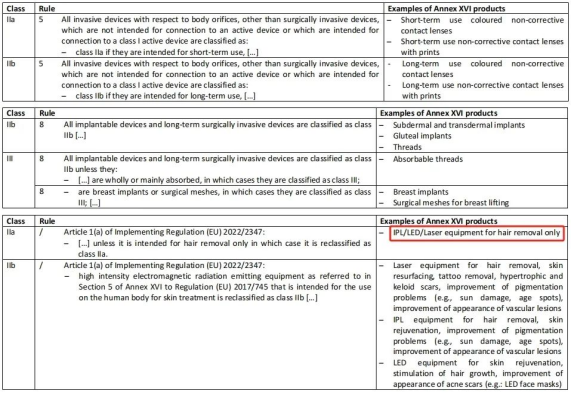
↑ 部分實例說明
醫療器械注冊谘詢認準金飛鷹
深圳:0755-86194173
廣州:020 - 82177679
湖南:0731-22881823
四川:028 - 68214295


