倒計時1個月!這些醫械產品出口歐盟必須要有UDI
文章出處:法規動態
網責任編輯:
金飛鷹
閱讀量:
發表時間:2025-04-22
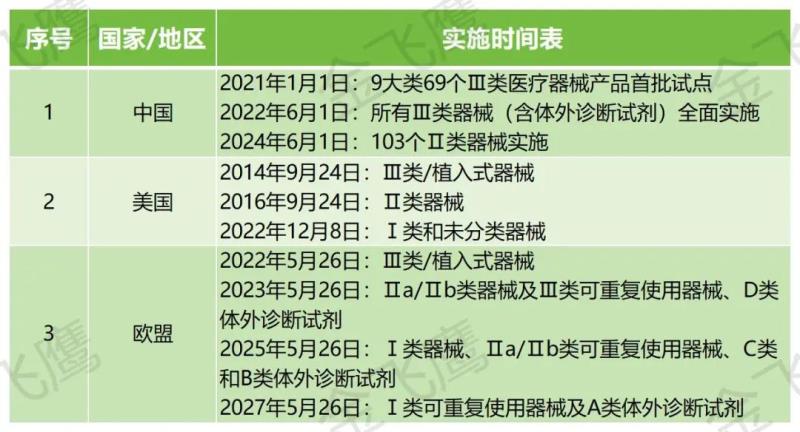
根據歐盟醫療器械法規(MDR)和體外診斷醫療器械法規(IVDR)UDI實施相關規定,2025年5月26日將迎來重要合規節點。屆時,以下醫療器械製造商在產品出口歐盟時必須貼上UDI標識:• 所有Ⅰ類醫療器械
• Ⅱa/Ⅱb類可重複使用醫療器械
• C類和B類體外診斷試劑而接下來還有一個合規時間點就是兩年後(2027年5月26日),屆時歐盟UDI的實施範圍將覆蓋所有醫療器械產品。金飛鷹在此提醒有歐盟出口需求的企業建立完善的UDI管理體係,確保產品順利進入歐盟市場。在此過程中,我們可以為您提供全方位的UDI合規解決方案,涵蓋軟硬件全流程支持:√ 國內&國際UDI法規深度解讀
√ 差異化市場準入策略谘詢
√ GS1等發碼機構編碼申請輔導
√ 智能標簽設計與自動化打印係統
√ UDI實施全流程驗證
√ 持續監測與更新服務
……
如您有任何有關UDI的疑問,歡迎隨時谘詢400-888-7587,金飛鷹專業團隊將為您提供高效合規的定製化解決方案!
深圳:0755-86194173
廣州:020 - 82177679
四川:028 - 68214295
湖南:0731-22881823
湖北:181-3873-5940
江蘇:135-5494-7827
廣西:188-2288-8311
海南:135-3810-3052
重慶:135-0283-7139