公告通知
您的位置:首頁2022世界杯南美区预选赛 公告通知
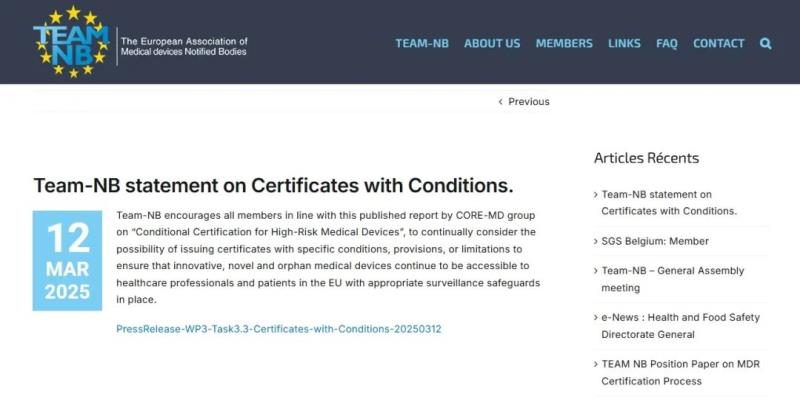
在該公告內容中,提到了一些常見的特定條件證書示例:
1. 臨時監督協議:製造商與公告機構之間達成協議,要求對上市後臨床隨訪(PMCF)活動進行臨時監督,例如每六個月進行一次,而不僅僅是按照常規的技術文件監督或定期安全性更新報告(PSURs)評估。
2. 使用限製:限製設備的預期用途,確保在某些特定人群(如兒科)使用時,需要生成額外的PMCF數據以補充臨床評估。
3. 證書有效期縮短:將證書的有效期從通常的五年縮短至三年,以確保在較短時間內重新評估設備的安全性和有效性。
4. 銷售限製:限製設備的銷售範圍,僅限於擁有適當資源、專家或經過培訓的人員的醫療機構使用。
5. 強製性數據輸入:將所有用於登記注冊的設備的安全性和性能數據強製性輸入。
醫療器械注冊谘詢認準金飛鷹 深圳:0755-86194173 廣州:020 - 82177679 四川:028 - 68214295 湖南:0731-22881823 湖北:181-3873-5940 江蘇:135-5494-7827 廣西:188-2288-8311 海南:135-3810-3052 重慶:135-0283-7139