公告通知
您的位置:首頁2022世界杯南美区预选赛 公告通知

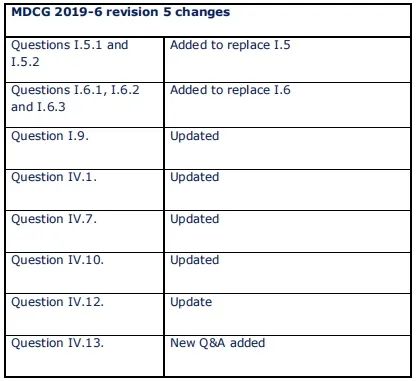
近日,歐盟發布了有關公告機構要求問答的指南文件MDCG 2019-6 rev.5,對該指南文件進行了以下更新:
適用的評估要求(包括用於證明符合要求的協調標準和通用規範)沒有改變,
評估是由明顯符合法規資格要求的人員進行的,
適用的報告要求在法規附件VII第4.6節中得到滿足,並確保可追溯性。
醫療器械注冊谘詢認準金飛鷹 深圳:0755-86194173 廣州:020 - 82177679 四川:028 - 68214295 湖南:0731-22881823 湖北:181-3873-5940 江蘇:135-5494-7827 廣西:188-2288-8311 海南:135-3810-3052 重慶:135-0283-7139