公告通知
您的位置:首頁2022世界杯南美区预选赛 公告通知

近日,FDA發布了FDA發布了針對脈搏血氧儀的最新指南草案。該草案定稿後,將取代2013年版脈搏血氧儀指南。
的來說,本指導文件草案提供了 FDA 關於非臨床和臨床性能測試的建議,以支持醫療用脈搏血氧儀(包括具有脈搏血氧儀功能的設備)的上市前提交。提出這些建議的部分原因是擔心脈搏血氧儀的準確性會受到人的皮膚色素沉著等因素的影響,同時為這些器械的性能評估提供信息,以支持上市前提交(無論提交類型如何),確保一致性,以促進對這些提交的高效審查。
除以上事項外,該指南草案還提供了標簽建議,旨在促進脈搏血氧儀的安全和有效使用,並幫助用戶了解與使用該設備相關的益處和風險。
接下來,我們就新版指南草案中部分新增內容及大家可能關注的內容進行簡單列舉:
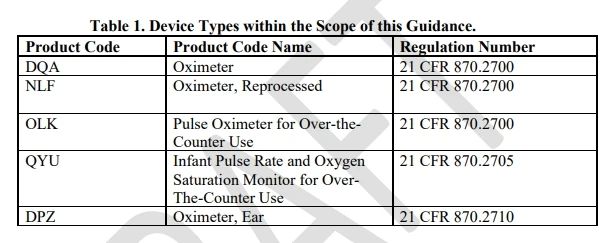
1、設備描述:設備適用範圍增加了產品代碼為QYU,OLK的血氧儀,其中QYU為非處方嬰兒脈率和血氧飽和度監測儀,OLK為非處方使用的脈搏血氧儀。適用的血氧儀設備產品代碼見下表。
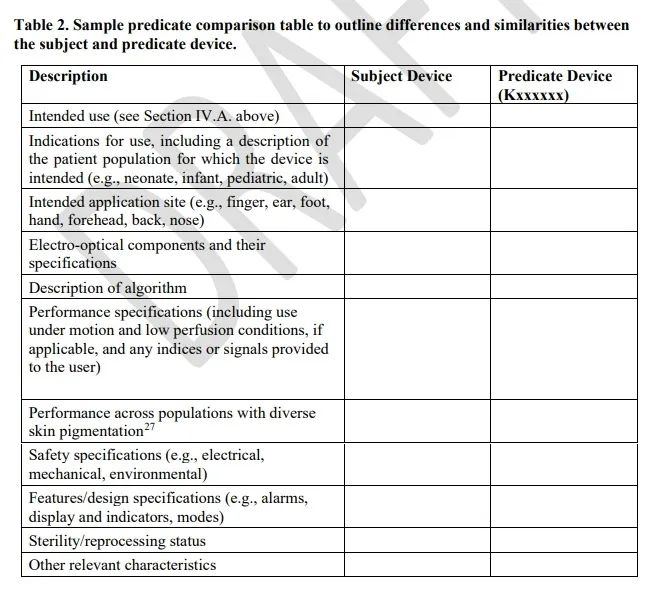
2、規定了等同器械比對的要求
3、標簽信息:FDA建議,將標簽的要求按如下產品類型進行區分:
所有脈搏血氧儀
處方脈搏血氧儀
OTC(非處方)脈搏血氧儀
之前已通過510k審核的脈搏血氧儀
4、軟件:脈搏血氧儀中的設備軟件功能可以確保測量準確、可靠和可重複,充分的軟件測試可保證設備按預期運行,建議參考FDA軟件變更指南、多功能器械指南;增加了網絡安全文檔的要求。
5、增加人因工程:FDA建議進行可用性評估,以識別潛在的使用錯誤,並幫助減輕錯誤來源。要求使用獨特的技術或非標準位置的血氧儀在設計初期就進行可用性評估,例如,脈搏血氧儀用於指尖,但以一種新穎的方式固定(例如,不是夾式)或使用不同的技術機製(例如,反射技術而不是透射技術)時。
6、增加無線技術評估:如果產品包含無線射頻功能,建議按照以下標準進行測試:AAMI TIR69、IEEE ANSI USE MCSC C63.27。
7、增加磁共振(MR)兼容性要求:對於在磁共振環境中使用的脈搏血氧儀,製造商需確保設備的安全性和兼容性,避免對患者造成傷害。
8、增加了需要重新提交510(k)的重大變更示例(包括但不限於):
對電光傳感器進行重大修改(例如,在光路中或附近使用新組件或新繃帶材料,對設備進行小型化的廣泛重新設計);
SpO2算法的重大修改;
SpO2軟件功能的輸入參數發生重大變化;
修改患者群體,例如修改為適用於12歲以下的兒科人群。
醫療器械注冊谘詢認準金飛鷹 深圳:0755-86194173 廣州:020 - 82177679 四川:028 - 68214295 湖南:0731-22881823 湖北:181-3873-5940 江蘇:135-5494-7827 廣西:188-2288-8311 海南:135-3810-3052 重慶:135-0283-7139