法規動態
您的位置:首頁2022世界杯南美区预选赛 法規動態

美國當地時間1月13日,FDA發布了上市前批準申請(PMA)和人道主義器械豁免(HDE)模塊審查的最終文件Premarket Approval Application and Humanitarian Device Exemption Modular Review。
FDA的模塊化審查指南為醫療器械的審批提供了一種新的、更靈活的方法,特別是在產品的臨床研究早期階段。通過允許分階段提交和審查非臨床數據和製造信息,申請者可以更有效地利用時間和資源,同時FDA也能夠更早地介入審查過程,提高審批效率。這一指南的發布,對於醫療器械行業來說是一個重要的進步,有助於加速創新產品的上市進程。不過值得注意的是,模塊化審查主要適用於處於臨床試驗早期階段的醫療器械。對於接近提交完整PMA或HDE申請,或設備設計尚不穩定的產品,模塊化審查可能不太適用。
指南文件附錄1中提到的模塊化審核流程圖如下:
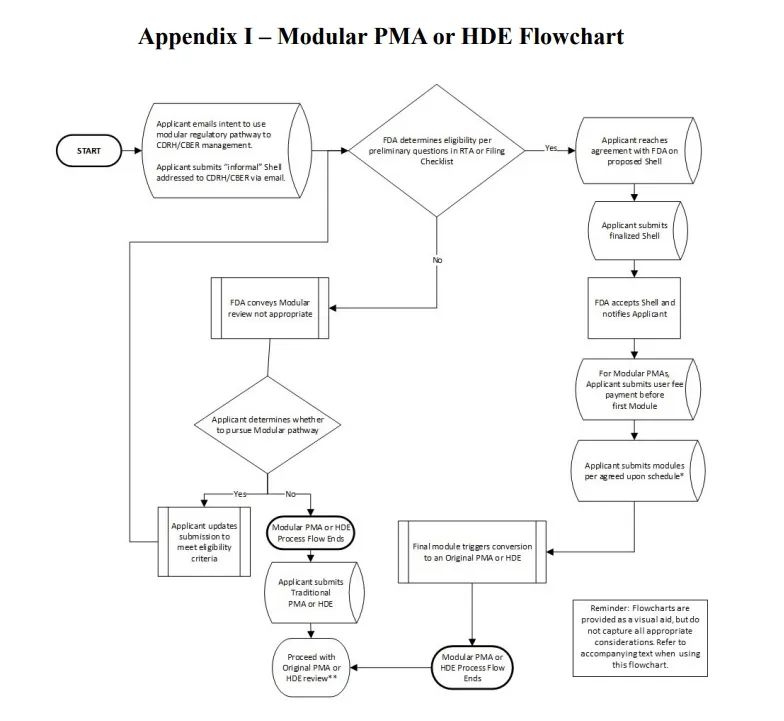
總的來說,該文件詳細介紹了模塊化審查程序的具體步驟、適用範圍、定義、用戶費用考慮以及提交模塊化PMA或HDE的行業指導,附錄後還包含了常見問題解答。
醫療器械注冊谘詢認準金飛鷹 深圳:0755-86194173 廣州:020 - 82177679 四川:028 - 68214295 湖南:0731-22881823 湖北:181-3873-5940 江蘇:135-5494-7827 廣西:188-2288-8311 海南:135-3810-3052 重慶:135-0283-7139