行業幹貨
您的位置:首頁2022世界杯南美区预选赛 行業幹貨
眾所周知,開展藥物臨床試驗必須提供臨床試驗用藥物的藥檢報告;同樣,醫療器械臨床試驗中產品檢驗報告也是不可或缺的。隻有檢驗合格,方可開展臨床試驗或者申請注冊、進行備案。而產品檢驗報告除了規定的注冊檢驗外,還常見委托檢驗、自檢報告等多種形式。
這些不同類型的檢驗報告各代表什麼意思?分別適用何種情況?都有什麼區別呢?
為貫徹落實鼓勵醫療器械產業創新發展的要求,進一步深化“放管服”改革,新版《醫療器械注冊與備案管理辦法》(2021年8月26日公布)明確提出,醫療器械產品檢驗報告可以是醫療器械注冊申請人、備案人的自檢報告,也可以是委托有資質的醫療器械檢驗機構出具的檢驗報告。這是醫療器械注冊工作要求的重大調整,以前的注冊檢驗,現在委托檢驗和注冊自檢均給予認可。
下麵我們詳細介紹下三種類型產品檢驗報告。
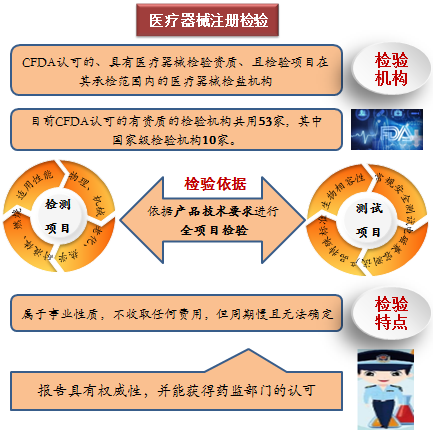
注冊檢驗是指國家藥品監督管理局認可的、具有醫療器械檢驗資質、且檢驗項目在其承檢範圍內的醫療器械檢測機構,依據產品技術要求對申報產品進行全項目檢驗,並出具檢驗報告。
目前國家藥監局認可的有資質的檢驗機構共有53家,其中國家級檢驗機構10家。注冊檢驗屬事業性質,不收取任何費用,但需排隊候檢,周期慢且無法確定,依據檢測機構目前承接項目預計周期。其報告具有權威性,並能獲得藥監部門的認可。隨著新版《醫療器械注冊與備案管理辦法》的實施,以前針對第二、三類醫療器械注冊檢驗的概念越來越淡化,委托檢驗和企業自檢逐漸走進行業舞台。
委托檢驗是企業委托藥監認可的檢測機構或者第三方檢測機構,依據標準和產品技術要求對產品安全性有效性做出技術評價,並取得檢驗報告的過程。委托檢驗具備商業性質,收取加速檢測的費用,周期相對普通的注冊檢驗較快。委托的檢驗機構不限於藥監係統,第三方有檢驗檢測機構資質認定證書及CMA資質,且承檢範圍內有對應標準的都可以。

但第三方機構是否有能力真正比肩藥監係統下醫療器械專業檢測機構所執行的檢驗檢測程序仍是一個重大挑戰,目前第三方出具的檢測報告可能不被認可。
注冊自檢是醫療器械注冊申請人按照產品技術要求,自行對其申報的產品進行全項目檢驗,並出具自檢報告。注冊申請人開展自檢工作,包括自己公司檢測、委托受托生產企業檢測,這些都不需要任何資質,但應具有產品技術要求中相應的自行檢驗能力,包括具備相應人員、設備、設施和環境等,並按照質量管理體係要求開展檢驗。自檢工作將會納入醫療器械質量管理體係核查中。
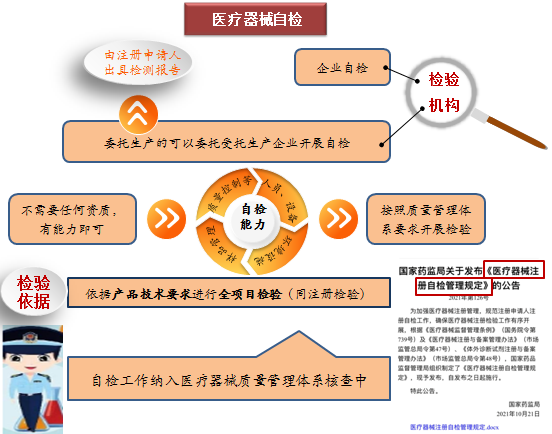
為規範自檢程序,2021年10月21日國家藥品監督管理局印發了《關於醫療器械注冊自檢管理規定》(國家藥品監督管理局公告第126號)。自檢不是放鬆要求,而是意味著企業將承擔更多的主體責任,是落實注冊人為第一責任人的一個具體表現。
新版《醫療器械注冊與備案管理辦法》的發布,明確了除注冊檢驗外,委托檢驗和注冊自檢等多種類型的檢驗報告均給予認可。對於企業來說,在醫療器械注冊工作中有了更多的選擇空間,
信息來源:浙大一院臨床試驗
排版整理:金飛鷹藥械
醫療器械注冊谘詢認準金飛鷹
深圳:0755-86194173
廣州:020 - 82177679
湖南:0731-22881823
四川:028 - 68214295